 |
Ileitis Monitor |
 |
| Onlinemagazin zur Ileitis des Schweines | ... online seit 2003 | |
von Dr. Manfred Stein, 22.08.2004
|
Unter Verwendung von wissenschaftlichem Material von Dr. Steve McOrist, Dr. Torsten Hardge, Dr. Volker Ohlinger, Prof. Dr. Joachim Pohlenz, Harm Voets DVM, Don Walter DVM. Welche verbreiteten Erkrankungen gleichen der Ileitis, und wie erkennen wir sie? Plötzliche Todesfälle mit blutigem Kot können auf Magenulzera der gastro-ösophagealen Region zurückzuführen sein. Solche Magenulzera werden häufig bei Mastschweinen gefunden. Bei entsprechend hochgradigen Veränderungen können die betroffenen Schweine in den Magen hinein verbluten. 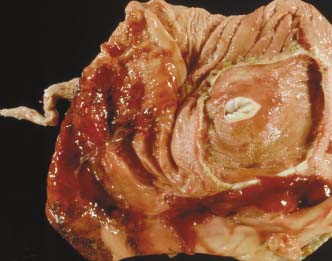
Foto 4.4.1 a: Ausgedehnte Ulzeration der gastro-ösophagealen Region des Magens eines Mastschweins, das durch Verbluten über diese Ulzera verendete. Die betroffenen Schweine werden anämisch und entwickeln teerartigen Kot. Bei der Sektion sind zum Teil sämtliche Darmschlingen mit Blut gefüllt. Ein Befund, der eine Hämorrhagische Enteritis vortäuschen kann. Die Darmschleimhaut ist jedoch nicht betroffen, und es besteht keine Diarrhoe. Die Ursache dieser Erkrankung wird seit vielen Jahren kontrovers diskutiert, und es gibt Hinweise darauf, dass der Verarbeitungsgrad des Futters (zu feines Zermahlen) ebenso wie Unterbrechungen in der Fütterung zur Entwicklung von Magenulzera beitragen. Im Zusammenhang mit einem schlechten gesundheitlichen Allgemeinzustand können sich Magenulzera bereits innerhalb von 24 Stunden nach der letzten Fütterung entwickeln. Stress in Verbindung mit einem hohen Kupfergehalt in der Ration gilt als eine weitere mögliche Ursache. Gelegentlich werden Selen- und Tocopherol- und/oder Zinksupplemente zur Prävention gegen die Entwicklung von Läsionen der Magenschleimhaut eingesetzt. Darmtorsion Darmverlagerungen kommen bei Mastschweinen relativ häufig vor. Meist ist der Dickdarm rotiert, was bei der Untersuchung zu Verwirrungen führen kann. Betroffene Schweine werden oft mit extrem erweitertem, aufgetriebenem Abdomen vorgestellt. Die Ursache von Darmverlagerungen ist nicht vollständig bekannt, möglich ist jedoch, dass plötzliche Bewegungen eines frisch gefütterten Schweines zu einer Rotation des Darmes führen. Schweinedysenterie Die Schweinedysenterie ist eine häufige Erkrankung in der Altersgruppe zwischen 6 und 20 Monaten.
Der ursächliche Erreger ist Brachyspira hyodysenteriae. In seltenen Fällen kann auch B. pilosicoli
nachgewiesen werden. Infektionen mit Brachyspira spp. sind auf den Dickdarm beschränkt, sie beziehen
also weder das Ileum noch Teile des oberen Dünndarms ein. Dies ist ein wichtiger differenzialdiagnostischer
Unterschied zur Ileitis. Bei der Sektion wird eine Typhlocolitis mit verdickten Schleimhautfalten festgestellt. Eine hochgradige entzündliche Reaktion führt zu vermehrter Rötung der Schleimhaut, die von großen Mengen Schleim und etwas Fibrin überzogen ist (Foto 4.3.3 a). Charakteristisch für die späteren Stadien ist eine hochgradige, ulzerative bis nekrotisierende Kolitis (Foto 4.3.3 b). Die histopathologischen Veränderungen haben einige Ähnlichkeiten mit denen einer Infektion durch Lawsonia intracellularis. In der frühen Phase (6-10 Tage) besteht eine mittel- bis hochgradige Proliferation in den tiefen Kryptenregionen. 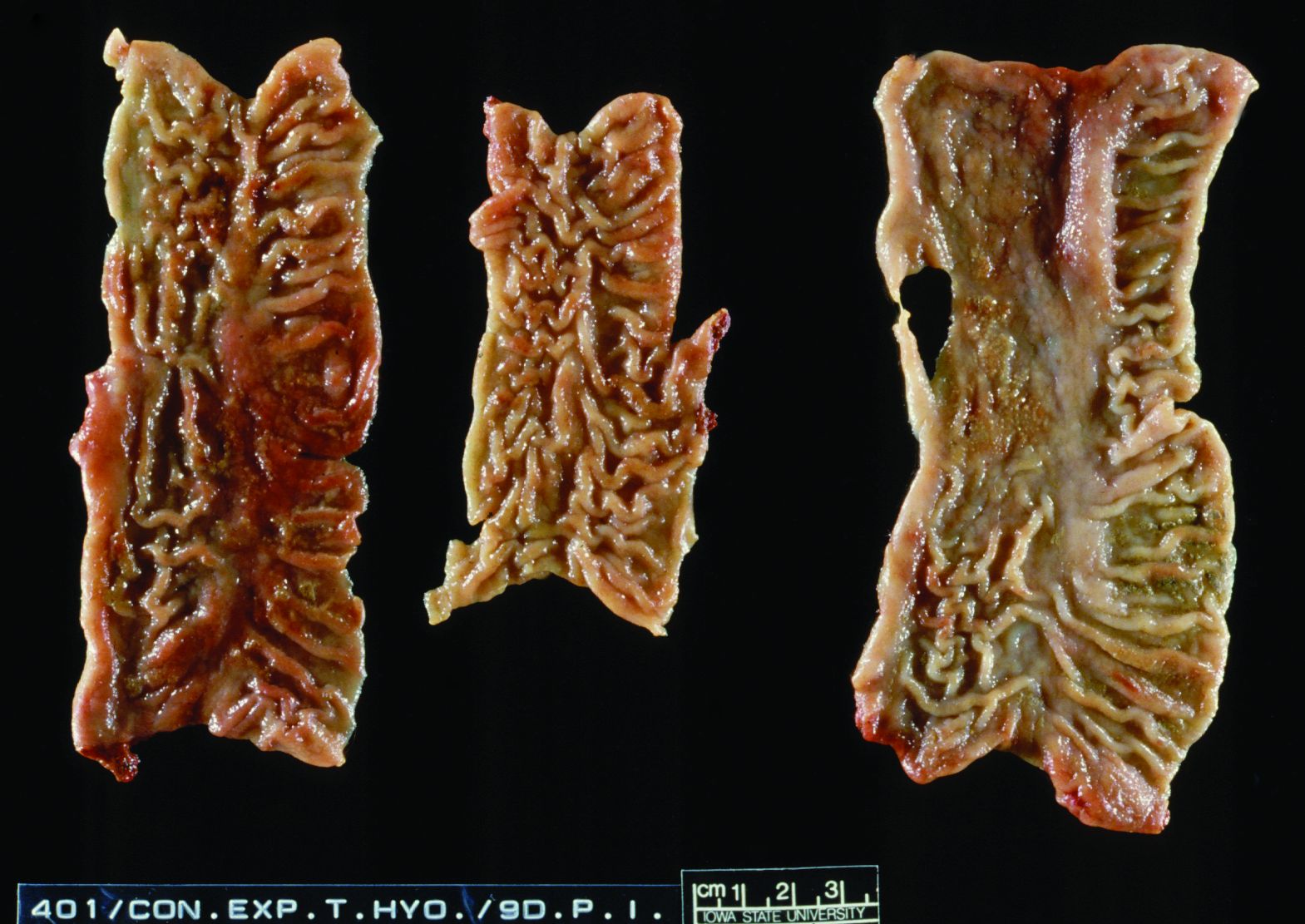
Foto 4.3.3 a: Drei Beispiele einer Kolonschleimhaut mit Läsionen infolge einer Infektion mit Brachyspira hyodysenteriae, 9 Tage nach experimenteller Infektion. Mittelgradige, fibrinöse Kolitis mit verdickten Darmschleimhautfalten und geringgradiger, fokaler Ulzeration. 
Foto 4.3.3 b: Hochgradige fibrinöse bis ulzerative Kolitis, 20 Tage post infectionem durch Brachyspira hyodysenteriae. Die Kryptenarchitektur ist insgesamt weniger stark verändert als bei der Lawsonieninfektion. Die Krypten sind erweitert, und von der mittleren Kryptenregion in Richtung Lumen befinden sich immer noch einige Becherzellen. Einige Oberflächenzellen werden in das Lumen hinein abgeschilfert (Foto 4.3.3 c). In hochgradigeren Fällen besteht eine Nekrose an der Schleimhautoberfläche und eine stärkere entzündliche Reaktion in der Darmwand (Foto 4.3.3 d). Zum Nachweis des Erregers in histologischen Schnitten wird die Silberfärbung (Warthin/Starry) seit vielen Jahren erfolgreich eingesetzt (Foto 4.3.3 e). Korkenzieherartig geformte, schwarz angefärbte Bakterien sind im Lumen der erweiterten Krypten zu erkennen. Nur gelegentlich wird Brachyspira spp. auch intrazellulär in dilatierten Becherzellen gefunden. Dies ist ein entscheidender Unterschied zu den obligat intrazellulären Lawsonia intracellularis, die stets intrazellulär in proliferierenden, unreifen Enterozyten zu finden sind. Bei Schweinen mit einer Infektion durch B. pilosicoli sind die Läsionen insgesamt weniger stark ausgeprägt, die Silberfärbung ist aber positiv. 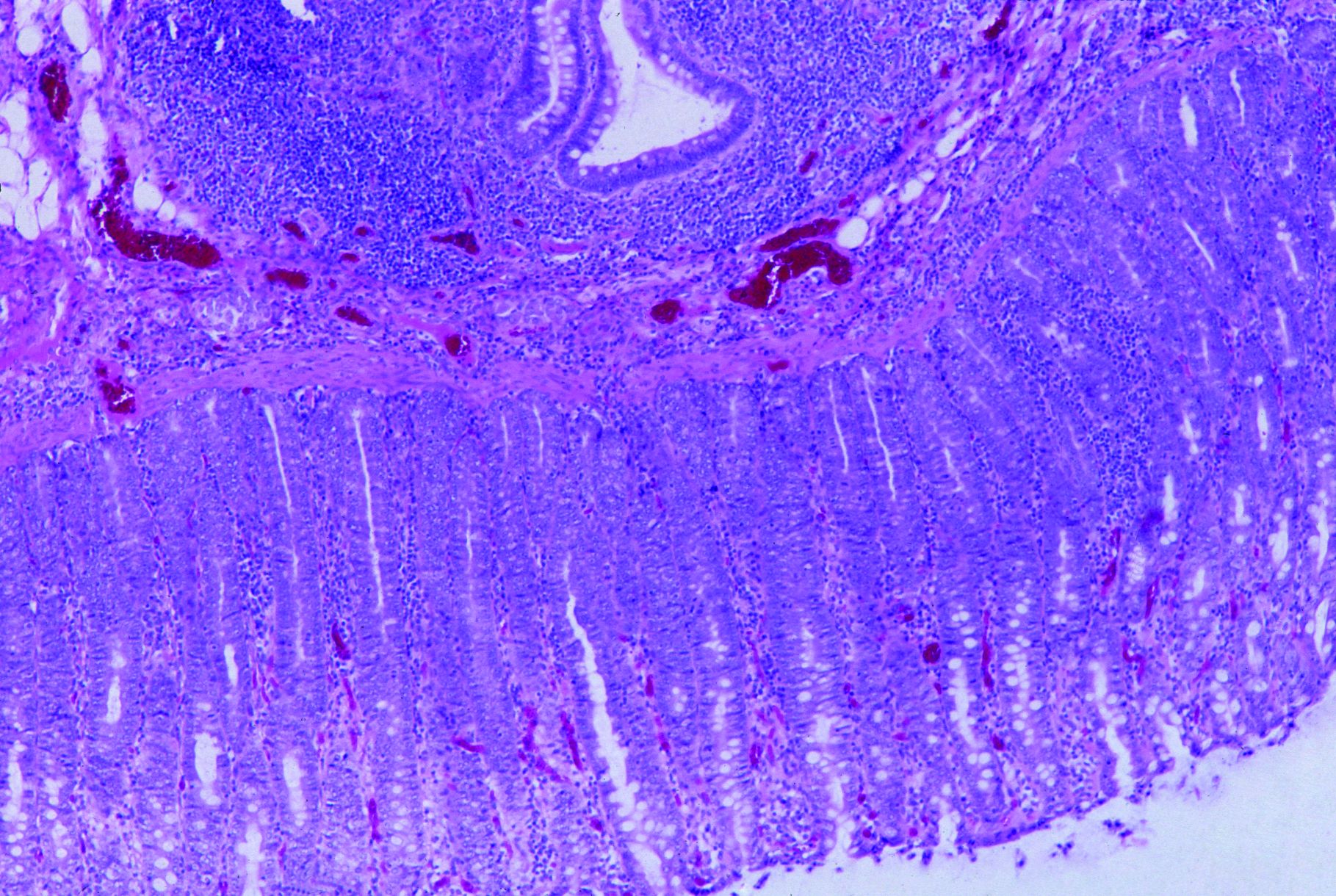
Foto 4.3.3 c: Histologischer Schnitt durch das Kolon: Proliferation in der Tiefe der Krypten, die Krypten sind mit unreifen Enterozyten ausgekleidet; Becherzellen sind in lumenwärts zur mittleren Kryptenregion verschoben. Es besteht eine geringgradig entzündliche Reaktion in der Lamina propria und eine Hyperplasie der submukösen lymphatischen Strukturen, 9 Tage post infectionem; H&E-Färbung (~ 125 x). 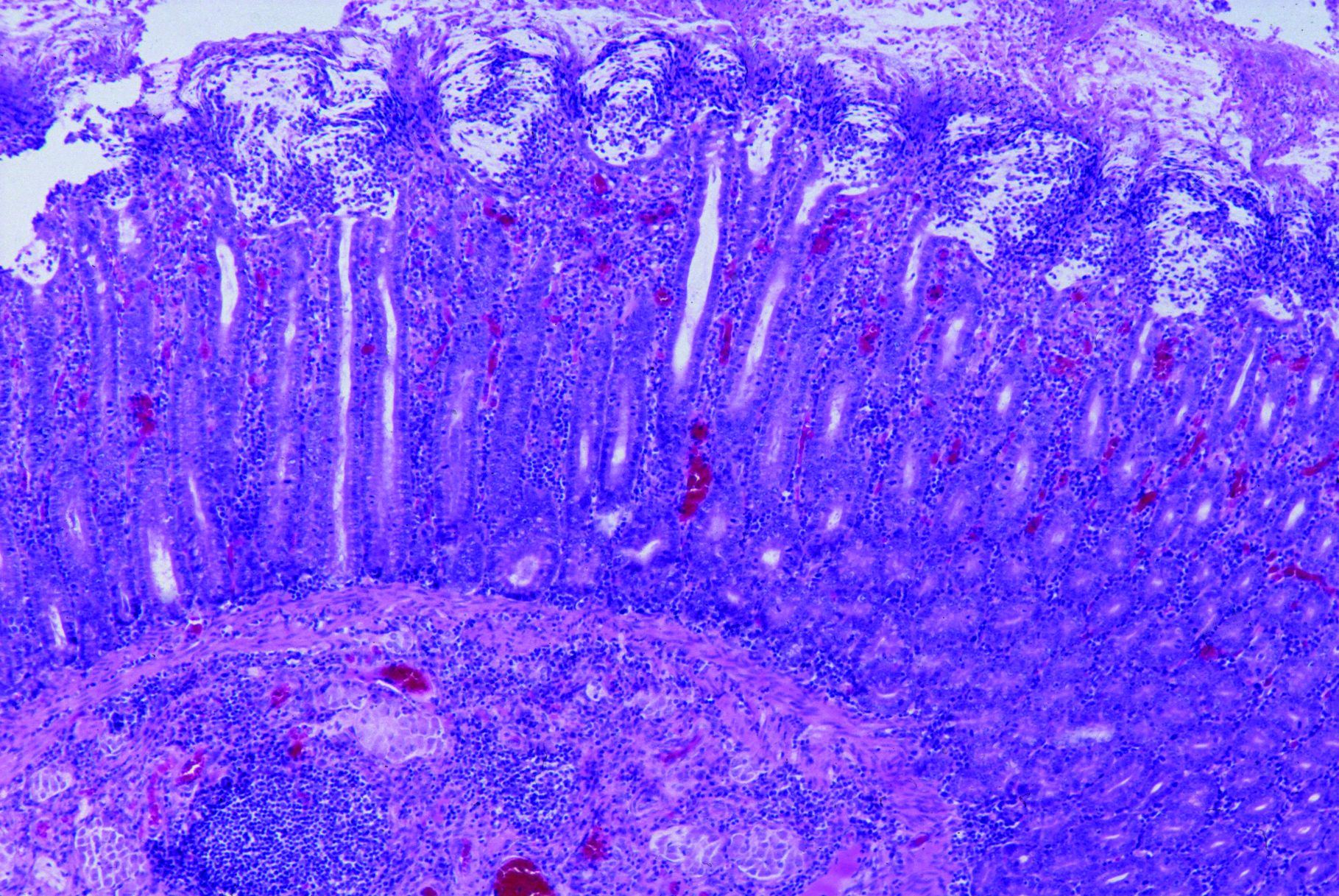
Foto 4.3.3 d Histologischer Schnitt des proximalen Kolons, 9 Tage post infectionem durch Brachyspira hyodysenteriae: Proliferation und Dilatation der mit Zelltrümmern angefüllten Krypten. Hochgradige Nekrose an der Schleimhautoberfläche, moderate zelluläre Infiltration der Lamina propria und der Submukosa. 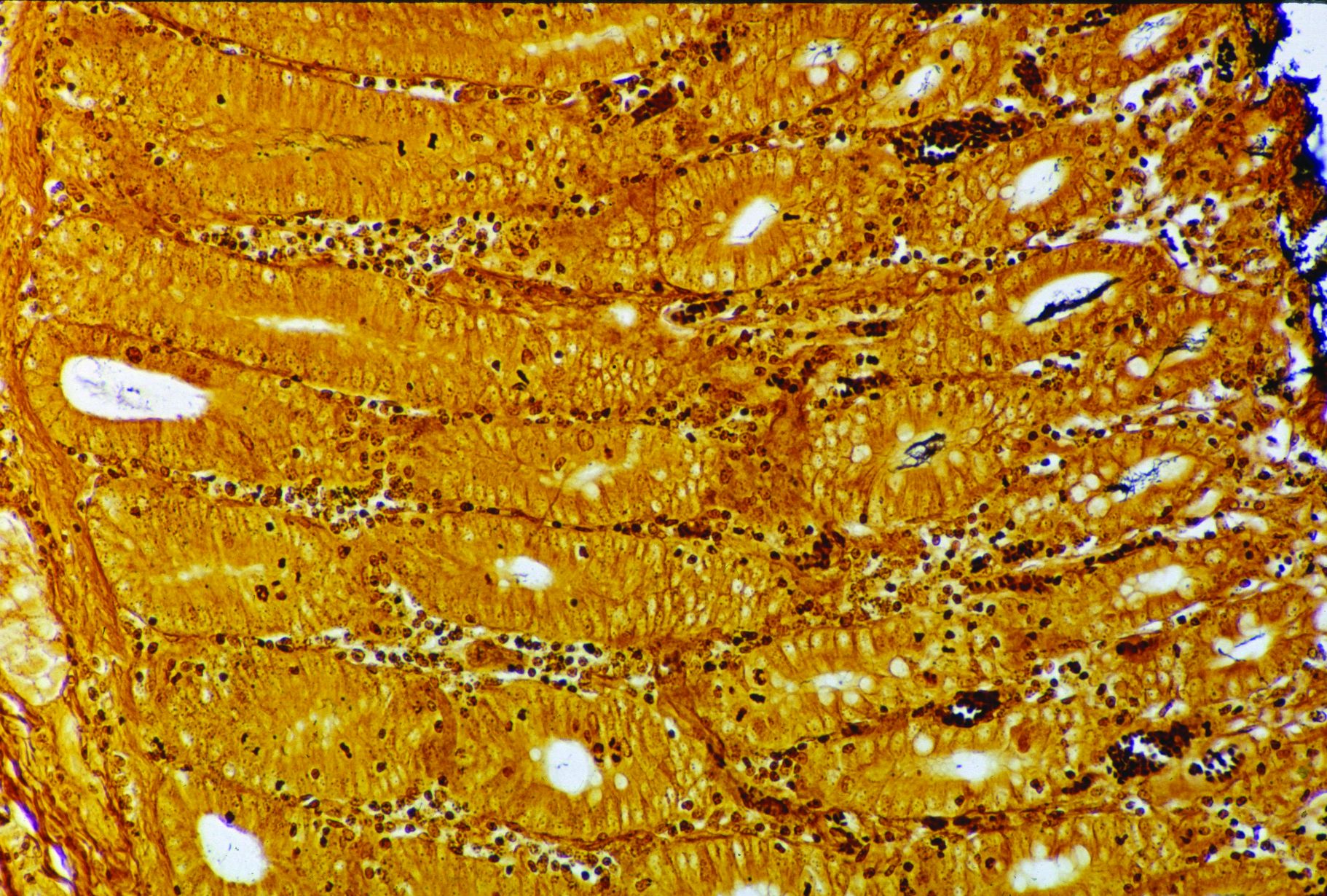
Foto 4.3.3 e: Silberfärbung (W&S) eines histologischen Schnitts aus dem Kolon eines Schweines mit Infektion durch Brachyspira hyodysenteriae: Korkenzieherartige, schwarz angefärbte Bakterien im Lumen von Krypten (~500x). Zu beachten ist, dass Lawsonia intracellularis mit derselben Methode angefärbt wird. Die eindeutige Differenzierung erfolgt deshalb mit Hilfe der IHC mit spezifischen monoklonalen Antikörpern. Diagnostische Methoden zum Nachweis von Brachyspira spp. In frischen Proben abnormer Schleimhaut oder Kottupferproben können Brachyspira spp. durch Dunkelfelduntersuchung mit dem Phasenkontrastmikroskop direkt mikroskopisch nachgewiesen werden. Darüber hinaus kommen spezifische Färbemethoden zum Einsatz. Brachyspira spp. können auch kultiviert werden, die Kultur muss jedoch innerhalb von 24 Stunden nach der Probenentnahme angelegt werden. Für die endgültige Identifizierung eines Isolates oder für die Bestätigung der Diagnose und die Bestimmung des Genotyps von Brachyspira spp. können differenzierende PCR-Methoden direkt an den klinischen Proben angewendet werden. Porzine Salmonellose In seltenen Fällen tritt eine enterische Salmonellose bei Mastschweinen auf. Die Infektion kann sowohl den Dünndarm als auch den Dickdarm einbeziehen. Das typische pathologische Muster der porzinen Salmonellose ist eine fibrinöse, nekrotisch-ulzerative Kolitis. Insbesondere bei Infektionen durch Salmonella cholerasuis var. Kunzendorf wird eine nekrotische bis ulzerative Typhlokolitis in Regionen mit lymphoglandulären Komplexen deutlich. Diagnostische Methoden zum Nachweis von Salmonella spp. Kot- und Organproben werden direkt in mindestens zwei selektiven Festnährböden zur Identifizierung Salmonellen verdächtiger Kolonien inokuliert. Die Phagentypisierung eines Salmonellenisolates basiert auf der Sensibilität eines bestimmten Isolates gegenüber verschiedenen Bakteriophagen in entsprechenden Verdünnungen. In jüngsten Veröffentlichungen wird der Nachweis des Phagentyps von Salmonella spp. mit Hilfe der PCR beschrieben. PCR-Methoden stehen zum Nachweis von Salmonella spp. in klinischen Proben oder zur Identifikation von Isolaten zur Verfügung. Zu den gängigen serologischen Methoden zum Nachweis von Antikörpern gegen Salmonella spp. gehören der ELISA, Agglutinationstests sowie Antiglobulin- und Komplementbindungstests. Insbesondere der ELISA eignet sich sehr gut für die Überwachung des Infektionsstatus einer Schweineherde. Da auch subklinische Infektionen auftreten, reicht der Nachweis von Salmonella spp. im Kot (insbesondere nach Anreicherung) oder der Nachweis von Antikörpern gegen Salmonellen allein nicht aus, um Salmonellen als Ursache einer entsprechenden akuten Erkrankung eindeutig zu bestätigen bzw. auszuschließen. Eine wertvolle unterstützende Maßnahme ist die histopathologische Untersuchung multipler Proben des Dünn- und Dickdarms und der Leber. Dies gilt insbesondere für die differenzialdiagnostische Abgrenzung der Salmonellose gegenüber der Proliferativen Enteritis und der Schweinedysenterie. Klassische Schweinepest Eine hämorrhagische bis nekrotisierende Enteritis ist eines der möglichen klinischen Merkmale der subakuten bis chronischen Form der klassischen Schweinepest. Es handelt sich um eine hoch kontagiöse Infektion durch Pestiviren und eine der meldepflichtigen Krankheiten der Liste A der OIE. Bei entsprechender Darmsymptomatik darf diese ökonomisch bedeutsame Erkrankung bei keiner Differenzialdiagnose fehlen. Die pathologischen Veränderungen im Ileum und im Kolon sind von den Ileitis-Verlaufsformen PHE bzw. NE nicht zu unterscheiden (Foto 4.3.5 a). In den USA wurde die klassische Schweinepest über viele Jahre nicht diagnostiziert. Dagegen gab es in Europa in den letzten Jahren einige sehr kostspielige, seuchenhafte Ausbrüche. Wichtig ist, dass jeder, der sich mit Schweinegesundheit beschäftigt, ausreichend über die klassische Schweinepest informiert ist, da diese Erkrankung grundsätzlich in jedem Land jederzeit unerwartet und plötzlich auftreten kann. Dies gilt natürlich vor allem für Länder mit intensiver Schweineproduktion. 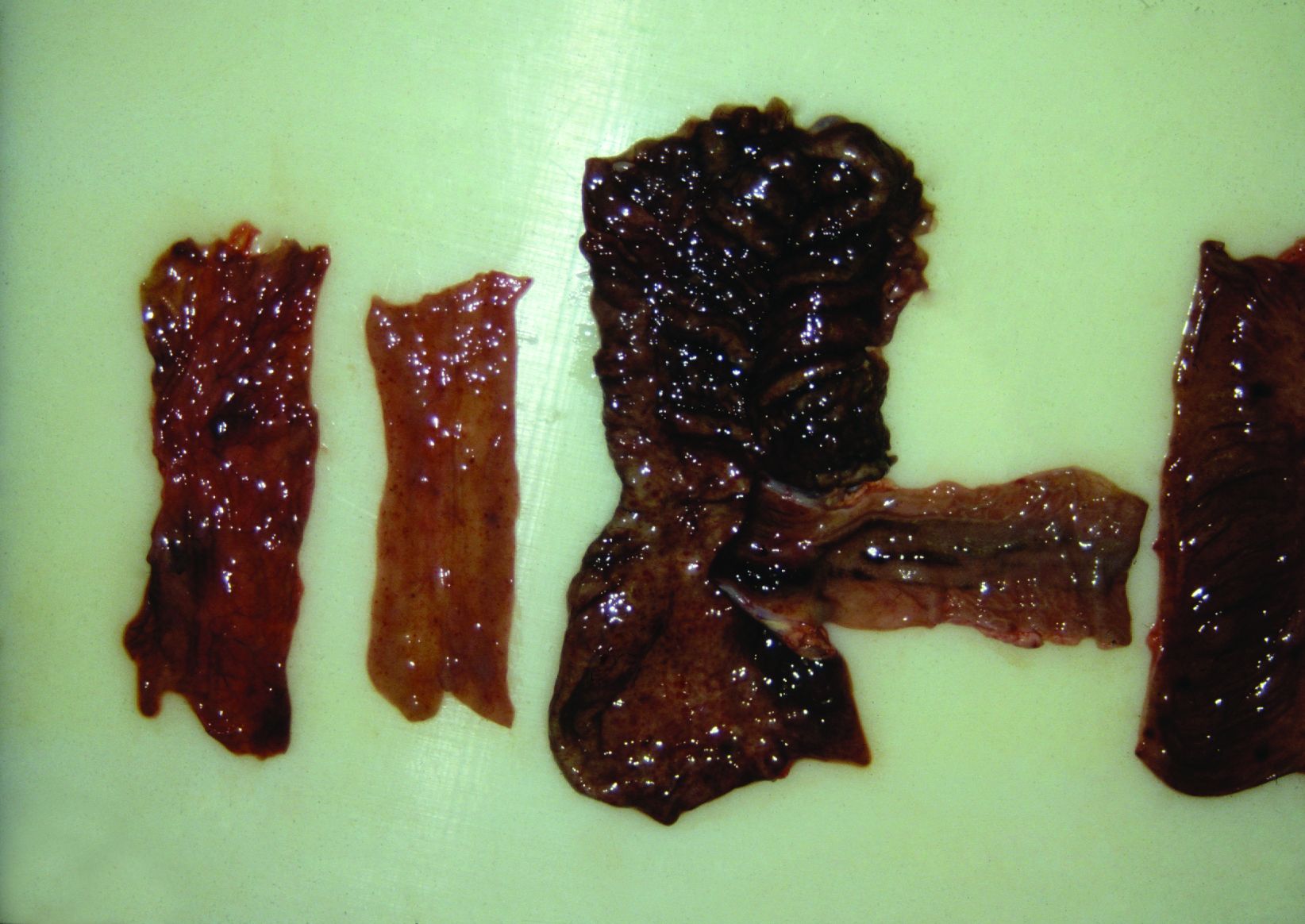
Foto 4.3.5 a Hämorrhagische bis fibrinöse Enteritis im Dünn- und Dickdarm eines experimentell mit dem Schweinepestvirus infizierten Mastschweins: Dünndarm rechts, Teile des Ileums, Zäkums und Kolons in der Mitte und zwei Kolonproben links. Diagnostische Methoden zum Nachweis des Virus der klassischen Schweinepest Im Unterschied zur akuten Form der klassischen Schweinepest ist es in chronischen Fällen praktisch nicht möglich, eine klinische Diagnose zu stellen, da die klinischen Symptome und die pathologischen Veränderungen sehr variabel und keineswegs spezifisch sind. Die Diagnose am lebenden Tier wird zudem dadurch erschwert, dass betroffene Schweine häufig gleichzeitig mit anderen Erregern koinfiziert sind. Die endgültige Diagnose erfolgt in hoch spezialisierten Labors durch den Nachweis des Virusantigens und des Virusgenoms, die Isolation des Virus oder den Nachweis von Antikörpern. Bei Proben klinisch erkrankter Schweine ist der Virusnachweis zu empfehlen. Für die Virusisolation können periphere Blutleukozyten oder Gewebepräparate von Tonsillen, Milz, Niere und Ileum in Schweinezellkulturen inkubiert werden. Die Virusisolation in Kombination mit der Immunfluoreszenzfärbung gilt heute als der Goldstandard für den Nachweis des Virus der klassischen Schweinepest. Alternativ können auch eine molekularbiologische Methode (RT-PCR) oder ein ELISA zum Nachweis von Antigen eingesetzt werden. An frisch tief gefrorenen Gewebeschnitten führt der direkte Fluoreszenzantikörpertest (FA) deutlich schneller zu vorläufigen Ergebnissen als die Methode der Virusvermehrung in Zellkulturen, allerdings bei eingeschränkter diagnostischer Sicherheit. Der Antikörpernachweis ist ein wertvolles Screeningverfahren zur Überwachung verdächtiger Betriebe. Zur Verfügung stehen verschiedene Methoden, basierend auf ELISA-Techniken, Inhibiting-Immunfluoreszenz-Assays (IFA) und Neutralisationsimmunfluoreszenz-Assays (NIA). ELISA-positive oder -verdächtige Seren müssen aufgrund der engen Antigenverwandtschaft zwischen dem Virus der klassischen Schweinepest und anderen Pestiviren wie BVDV und BDV zur Bestätigung der Diagnose mittels IFA oder NIA nachgetestet werden. Porzine Coronavirus-Infektionen bei älteren Schweinen Eine Infektion durch porzine enterische Coronaviren führt entweder zu einer Transmissiblen Gastroenteritis (TGE) oder einer Epizootischen Virusdiarrhoe (EVD) mit dem europäischen Prototyp CV 777. Unter bestimmten Umständen können sich zusätzlich zu den erkrankungstypischen Dünndarmläsionen auch Veränderungen im Dickdarm entwickeln und zu einer katarrhalischen bis fibrinösen Typhlokolitis führen. Bei Mastschweinen und Sauen kann eine plötzlich einsetzende, hochgradige Diarrhoe entstehen. Die Erkrankung geht in der Regel mit Verlusten in der Ferkelaufzucht einher und wird meist von weiteren Symptomen begleitet. Der vollständige Verlust der Darmzotten im größten Teil des Dünndarms ist für den Histopathologen der signifikanteste Befund neben dem immunhistochemischen Nachweis von Virusantigen in Enterozyten. Diagnostische Methoden zum Nachweis des TGEV und EVDV. Für die Diagnose einer Infektion durch das TGEV stehen zahlreiche, weithin erprobte diagnostische Verfahren zur Verfügung, wie zum Beispiel der Nachweis von Virusantigen und Virusgenom, die mikroskopische Untersuchung, die Virusisolation und der Nachweis spezifischer Antikörper. Mit Hilfe der elektronenmikroskopischen Untersuchung von Kotproben kann der Untersucher Coronavirus-artige Partikel nachweisen, eine Unterscheidung zwischen TGEV und EVDV ist aber nicht möglich. EVD-Virus lässt sich sehr einfach mit Hilfe von ELISA-Verfahren für EVDV-Antigen aus Kotproben oder indirekt durch den Nachweis spezifischer Antikörper gegen EVDV im Serum bestätigen. Infektionen durch Escherichia coli Infektionen durch E. coli treten häufig bei Absatzferkeln auf. In seltenen Fällen mit Beteiligung bestimmter E. coli-Stämme äußern sie sich als schwere hämorrhagische Darmerkrankung. Die betroffenen Schweine sterben oft infolge des so genannten Schocksyndroms, einer Form der Ödemkrankheit (E. coli-Enterotoxämie). Diese Erkrankung kann jedoch relativ eindeutig von der hämorrhagischen Enteritis durch Lawsonia intracellularis unterschieden werden. E. coli-Toxine verursachen ein hochgradiges hämorrhagisches Geschehen, wobei die entzündliche Reaktion der Darmschleimhaut eher subtil erscheint. In der Regel werden eine profuse, wässrige Diarrhoe mit schneller Dehydratation, eine Azidose und in seltenen Fällen sogar Todesfälle noch vor Beginn der Diarrhoe beobachtet. Charakteristisch ist ein erweiterter und dehydrierter Dünndarm mit gelblicher, leicht schleimiger Flüssigkeit. Das Kolon enthält eine ähnliche Flüssigkeit. Oft ist die Magenschleimhaut im Fundusbereich vermehrt gerötet. Plötzlich verendete Schweine weisen ein fleckenförmiges, kutanes Erythem auf. Die Bestätigung der Diagnose erfolgt über den direkten histologischen Nachweis einer entsprechenden Kolonisierung der Zotten. Die Zotten haben in der Regel eine physiologische Länge und weisen zahlreiche kleine, an den absorptiven Enterozyten haftende, stäbchenförmige Bakterien auf. Mit Hilfe der IHC und anderer immunologischer Diagnoseverfahren können die Pilusantigene der ursächlichen E. coli in Proben der Darmschleimhaut nachgewiesen werden. Die einzelnen E. coli-Stämme können aus Gewebeproben auf Blutagarplatten isoliert werden. In hämolytischen E. coli-Isolaten lassen sich Pilusantigene durch Agglutination mit spezifischen Antiseren nachweisen. Ferner stehen differenzierende PCR-Methoden zum Nachweis der Gene für die Pilusantigene und für Toxine in E. coli-Kulturen zur Verfügung. |
|
audiatur et altera pars |
| Eine Seite der animal-health-online-Gruppe. | © Alle Rechte vorbehalten |